《江蘇省揚州市寶應(yīng)縣城鎮(zhèn)中學(xué)高三化學(xué)一輪復(fù)習(xí) 弱電解質(zhì)的電離平衡課件》由會員分享���,可在線閱讀���,更多相關(guān)《江蘇省揚州市寶應(yīng)縣城鎮(zhèn)中學(xué)高三化學(xué)一輪復(fù)習(xí) 弱電解質(zhì)的電離平衡課件(10頁珍藏版)》請在裝配圖網(wǎng)上搜索。
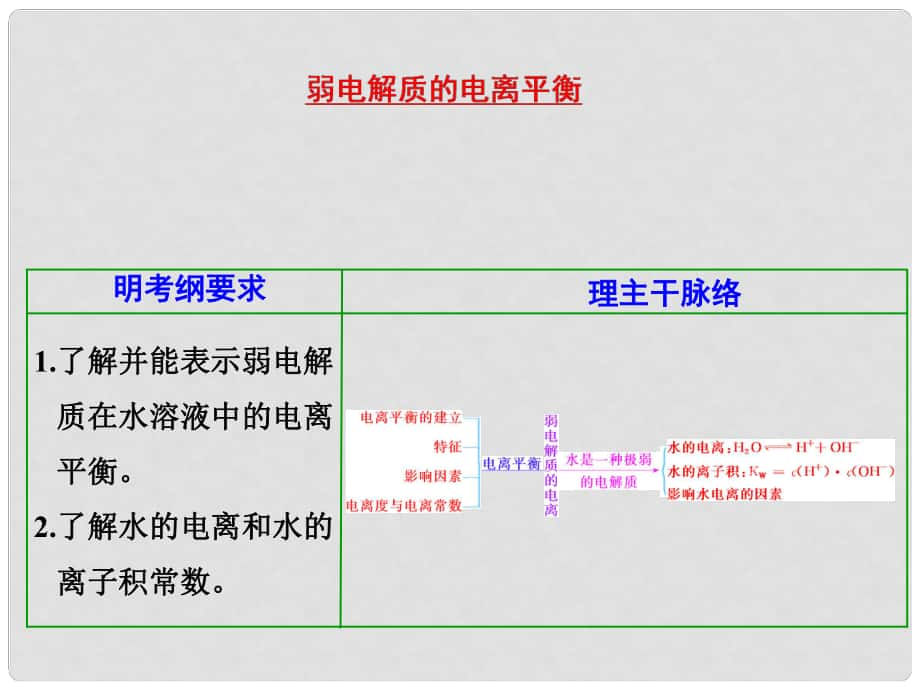
1���、1.了解并能表示弱電解了解并能表示弱電解 質(zhì)在水溶液中的電離質(zhì)在水溶液中的電離 平衡���。平衡���。2.了解水的電離和水的了解水的電離和水的 離子積常數(shù)。離子積常數(shù)���。 理主干脈絡(luò)理主干脈絡(luò)明考綱要求明考綱要求向向 移動移動加入能與電解質(zhì)離子反應(yīng)加入能與電解質(zhì)離子反應(yīng)的物質(zhì)的物質(zhì)向向 移動移動加入與弱電解質(zhì)相加入與弱電解質(zhì)相同離子的強電解質(zhì)同離子的強電解質(zhì)相同相同離子離子向向 移動移動稀釋溶液稀釋溶液濃度濃度向向 移動移動升高溫度升高溫度溫度溫度電離程度電離程度變化變化電離平衡移動方向電離平衡移動方向外界條件外界條件右右右右左左右右增大增大增大增大減小減小增大增大增大增大 7 促進促進 增大增大抑制抑制
2���、減小減小抑制抑制促進促進c(H)c(OH) 1.01014溫度溫度增大增大類型一類型一 外界條件對弱電解質(zhì)電離平衡的影響外界條件對弱電解質(zhì)電離平衡的影響【例例1】 已知已知0.1mol/L的醋酸溶液中存在電離的醋酸溶液中存在電離平衡:平衡:CH3COOH CH3COO +H+,要使溶液中���,要使溶液中c(H+)/c(CH3COOH)值增大���,可以采取的措施是值增大,可以采取的措施是A加少量燒堿溶液加少量燒堿溶液 B升高溫度升高溫度 C加少量冰醋酸加少量冰醋酸 D加水加水BD類型二類型二 強弱電解質(zhì)的性質(zhì)比較強弱電解質(zhì)的性質(zhì)比較【例例2】 在一定溫度下���,有在一定溫度下���,有a. 鹽酸���,鹽酸���,b. 硫酸
3���、,硫酸���,c.醋酸三種酸:醋酸三種酸:當(dāng)三種酸物質(zhì)的量濃度相同時���,當(dāng)三種酸物質(zhì)的量濃度相同時,c(H+)由大到小的順序由大到小的順序是是 ���。同體積���、同物質(zhì)的量濃度的三種酸,中和同體積���、同物質(zhì)的量濃度的三種酸���,中和NaOH的能力由大到小的能力由大到小的順序是的順序是 。當(dāng)三者當(dāng)三者c(H+)相同時���,物質(zhì)的量濃度由大到小的順序是相同時���,物質(zhì)的量濃度由大到小的順序是 ���。當(dāng)三者當(dāng)三者c(H+)相同、體積相同時���,分別放入足量的鋅���,相同狀況相同、體積相同時���,分別放入足量的鋅���,相同狀況下產(chǎn)生氣體的體積由大到小的順序是下產(chǎn)生氣體的體積由大到小的順序是 。當(dāng)當(dāng)c(H+)相同���、體積相同時���,同時加入形狀、密度���、質(zhì)量完全相相同���、體積相同時,同時加入形狀���、密度���、質(zhì)量完全相同的鋅粒,若產(chǎn)生相同體積的氫氣(相同狀況)���,則開始時反應(yīng)速同的鋅粒���,若產(chǎn)生相同體積的氫氣(相同狀況),則開始時反應(yīng)速率的大小關(guān)系為率的大小關(guān)系為 ���。反應(yīng)所需時間的長短關(guān)系是���。反應(yīng)所需時間的長短關(guān)系是 。將將c(H+)相同的三種酸均加水稀釋至原來的相同的三種酸均加水稀釋至原來的100倍后���,倍后���,c(H+)由大由大到小的順序是到小的順序是 ���。例例2bac ba=c cab ca=b a=b=c a=bc ca=b
 江蘇省揚州市寶應(yīng)縣城鎮(zhèn)中學(xué)高三化學(xué)一輪復(fù)習(xí) 弱電解質(zhì)的電離平衡課件
江蘇省揚州市寶應(yīng)縣城鎮(zhèn)中學(xué)高三化學(xué)一輪復(fù)習(xí) 弱電解質(zhì)的電離平衡課件