《九年級化學(xué):第五單元化學(xué)方程式01復(fù)習(xí)題一 單項選擇題》由會員分享���,可在線閱讀��,更多相關(guān)《九年級化學(xué):第五單元化學(xué)方程式01復(fù)習(xí)題一 單項選擇題(3頁珍藏版)》請在裝配圖網(wǎng)上搜索��。
1�����、九年級化學(xué):第五單元 化學(xué)方程式 01復(fù)習(xí)題一 單項選擇題
可能用到的相對原子質(zhì)量:H—1 O—16 Al—27 C—12 K—39 Mn—55
Mg—24 P—31 Cl—35.5 Cu—64
一.選擇題
1.已知:xAl+yO2 zAl2O3的這個反應(yīng)中鋁�����、氧氣�����、氧化鋁的質(zhì)量比為( )
A.27:32:102 B.27:24:43 C.4:3:2 D.108:96:204
2.葡萄糖與O2作用是動植物呼吸的主要反應(yīng):C6H12Ox+
2����、6O2=6CO2+6H2O�,請判斷C6H12Ox中,x的值應(yīng)為 ( )
A. 12 B.9 C.6 D.3
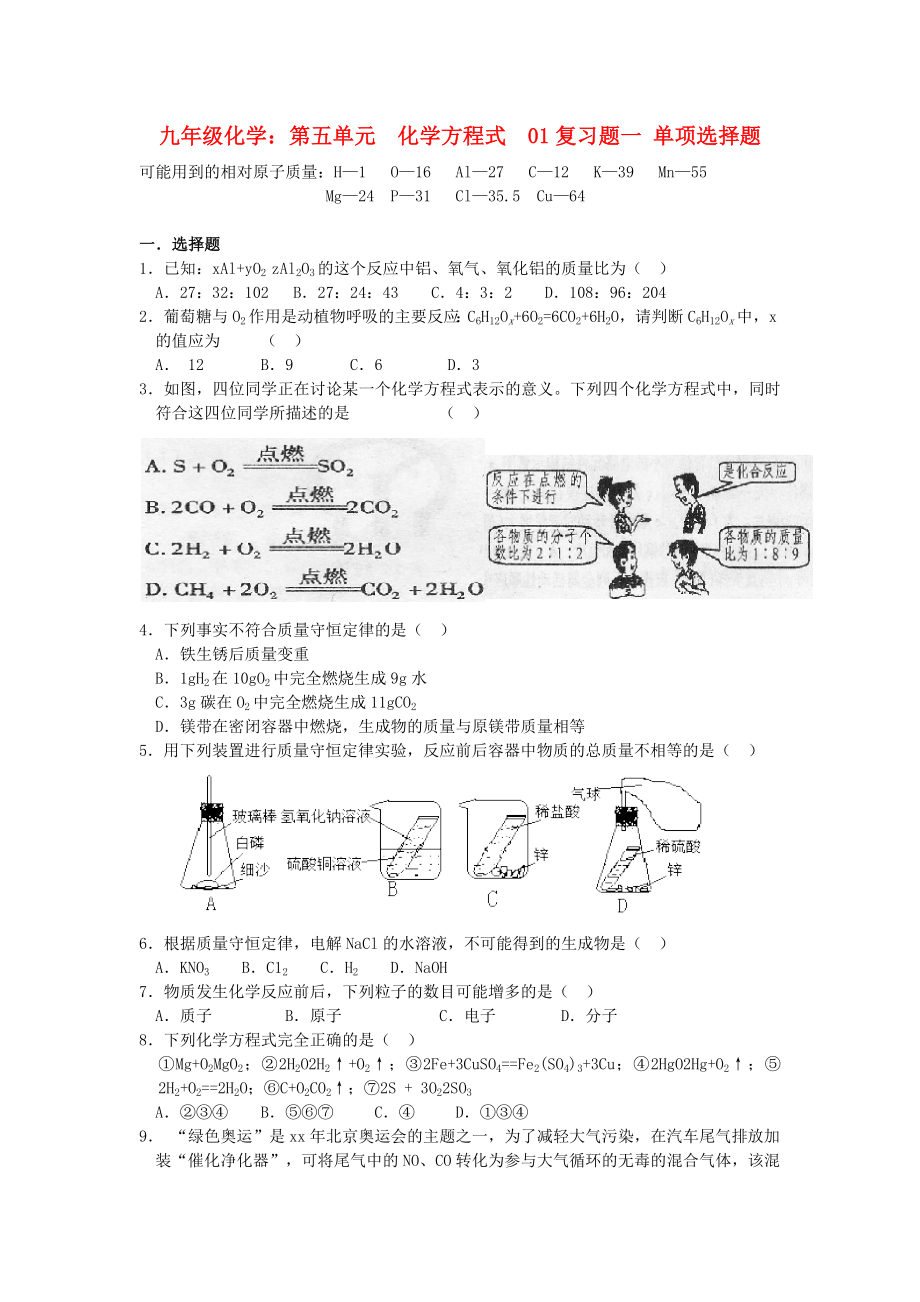
3.如圖�����,四位同學(xué)正在討論某一個化學(xué)方程式表示的意義。下列四個化學(xué)方程式中�����,同時符合這四位同學(xué)所描述的是 ( )
4.下列事實不符合質(zhì)量守恒定律的是( )
A.鐵生銹后質(zhì)量變重
B.1gH2在10gO2中完全燃燒生成9g水
C.3g碳在O2中完全燃燒生成11gCO2
D.鎂帶在密閉容器中燃燒��,生成物的質(zhì)量與原鎂帶質(zhì)量相等
5.用下列裝置進行質(zhì)量守恒定律實驗�����,反應(yīng)前后容器中物質(zhì)的總質(zhì)量不相等
3�����、的是( )
6.根據(jù)質(zhì)量守恒定律����,電解NaCl的水溶液,不可能得到的生成物是( )
A.KNO3 B.C12 C.H2 D.NaOH
7.物質(zhì)發(fā)生化學(xué)反應(yīng)前后���,下列粒子的數(shù)目可能增多的是( )
A.質(zhì)子 B.原子 C.電子 D.分子
8.下列化學(xué)方程式完全正確的是( )
①Mg+O2MgO2�;②2H2O2H2↑+O2↑���;③2Fe+3CuSO4==Fe2(SO4)3+3Cu����;④2HgO2Hg+O2↑;⑤2H2+O2==2H2O��;⑥C+O2CO2↑��;⑦2S + 3O22SO3
A.②③④ B.
4���、⑤⑥⑦ C.④ D.①③④
9. “綠色奧運”是xx年北京奧運會的主題之一,為了減輕大氣污染����,在汽車尾氣排放加裝“催化凈化器”,可將尾氣中的NO�����、CO轉(zhuǎn)化為參與大氣循環(huán)的無毒的混合氣體��,該混合氣體是 ( )
A.CO2�����、NH3 B.O2�����、CO2 C.N2、CO2 D.NO2����、CO2
10.完全電解Xg水,能得到5mL氧氣�,則同時可得到氫氣的質(zhì)量和體積分別為( )
A.8X/9,5mL B.X/9g���,10mL C.Xg����,5mL D.Xg����,10mL
11.如下圖所示,兩個甲分子反應(yīng)生成三個乙分子和一個丙分子���,則從
5�、圖示獲得的信息中���,不正確的是 ( )
A.分子的種類在化學(xué)反應(yīng)中發(fā)生了改變 B.該反應(yīng)的反應(yīng)類型為分解反應(yīng)
C.反應(yīng)生成的丙物質(zhì)屬于單質(zhì) D.乙分子中含有一個A原子�,一個B原子
12.取X物質(zhì)23.0g和Y物質(zhì)49.0g混合剛好完全反應(yīng),反應(yīng)的化學(xué)方程式如下:2X+Y=Z+W�,生成Z物質(zhì)的質(zhì)量為71.0g,已知物質(zhì)W的相對分子質(zhì)量為2���,則Z的相對分子質(zhì)量為 ( )
A.61 B.142 C.23 D.98
13.下列關(guān)于化學(xué)反應(yīng)"X2
6�����、十3Y2===2Z”的敘述錯誤的是 ( )
A.Z的化學(xué)式為XY3
B.若mg X2和ngY2恰好完全反應(yīng)��,則生成(m+n)g Z
C.若X2和Y2的相對分子質(zhì)量分別為M和N��,則Z的相對分子質(zhì)量為(M+N)
D.若ag X2完全反應(yīng)生成bg Z,則同時消耗(b一a)g Y2
14.實驗室制氧氣時��,用下列各組物質(zhì)混合加熱�,其中產(chǎn)生氧氣最多的是( )
A.10gKMnO4 B.10gKClO3 C.9gKClO3和1gMnO2 D.9gKClO3和1gKMnO4
15.下圖中“○”表示某種原子,“●”表示另一種原子��,下列反應(yīng)中����,能用該
7、圖表示其實質(zhì)的是( )
A.H2+Cl2==2HCl B.N2+3H2==2NH3 C.2CO+O2=2CO2 D.2H2+O2=2H2O
16.用I2O5可以測定空氣受CO污染的程度,發(fā)生反應(yīng)的化學(xué)方程式如下:I2O5+5CO==I2+5CO2��,根據(jù)生成CO2的多少��,可以判斷CO的含量�。關(guān)于這個反應(yīng),下列說法中正確的是( )
A.參加反應(yīng)的I2O5的質(zhì)量等于生成的I2的質(zhì)量
B.參加反應(yīng)的各物質(zhì)中的氧原子總數(shù)等于生成的CO2中的氧原子總數(shù)
C.反應(yīng)物所含元素種類與生成物所含元素種類不相同
D.參加反應(yīng)的I2O5和CO的質(zhì)量比等于生成的I2和CO2的質(zhì)
8����、量比
17.一定條件下發(fā)生的某反應(yīng)可表示為:A+3B=2C+2D(省略了方程式中的條件),當有9.6gB完全反應(yīng)時����,可生成3.6gD;當反應(yīng)生成4.4gC時����,可生成1.8gD;那么�,當有2.2gC生成時參加反應(yīng)的A的質(zhì)量是 ( )
A.0.5g B.0.7g C.1.5g D.2.8g
18.在汽車的擋風玻璃和司機之間常有一個安全氣囊,內(nèi)部放有硝酸銨 (NH4NO3)�,當汽車高速行駛中受到猛烈撞擊時,硝酸銨迅速分解��,產(chǎn)生大量一氧化二氮氣體和另一種氧化物����,充滿氣囊�����,填補在乘員與擋風玻璃�、方向盤之間�,防止乘員受傷。則硝酸按受撞擊后發(fā)生分解反應(yīng)中氮元素的化合價不
9��、可能是 ( )
A.-3價 B.+1價 C.+3價 D.+5價
19.研究物質(zhì)的變化時可使用具有放射性的18O作為“示蹤原子”��??茖W(xué)家希爾和尼爾研究證明,光合作用的通式更合理地表達為:6CO2+12H218OC6H12O6+6H2O+618O2
在光照充分的環(huán)境里�����,將一種植物——黑藻放入含有“示蹤原子”18O的水中�,一段時間后分析“示蹤原子”�,最有可能是 ( )
A.在植物體周圍的空氣中發(fā)現(xiàn) B.在植物體內(nèi)的淀粉和蛋白質(zhì)中發(fā)現(xiàn)
C.在植物體內(nèi)的C6H12O6中發(fā)現(xiàn) D.無法確定示蹤原子在什么地方出現(xiàn)
20.為了探究鐵和硫酸銅溶液反應(yīng)中量的關(guān)系,某興趣小組做了五組實驗�����,實驗結(jié)果記錄如下:
編號
加入鐵的質(zhì)量/g
硫酸銅溶液體積/mL
生成銅的質(zhì)量/g
1
1.12
10.0
1.28
2
x
10.0
2.56
3
3.36
10.0
3.84
4
4.48
10.0
4.98
5
5.60
20.0
y
則表格中記錄的x和y的數(shù)值應(yīng)分別為( )
A.2.24、4.98 B.2.24���、6.40 C.3.36�、5.12 D.3.36�、4.98
 九年級化學(xué):第五單元化學(xué)方程式01復(fù)習(xí)題一 單項選擇題
九年級化學(xué):第五單元化學(xué)方程式01復(fù)習(xí)題一 單項選擇題