《2018-2019年高中化學(xué)上學(xué)期《離子濃度大小比較》教學(xué)設(shè)計(共4頁)》由會員分享���,可在線閱讀���,更多相關(guān)《2018-2019年高中化學(xué)上學(xué)期《離子濃度大小比較》教學(xué)設(shè)計(共4頁)(5頁珍藏版)》請在裝配圖網(wǎng)上搜索。
1�、精選優(yōu)質(zhì)文檔-----傾情為你奉上
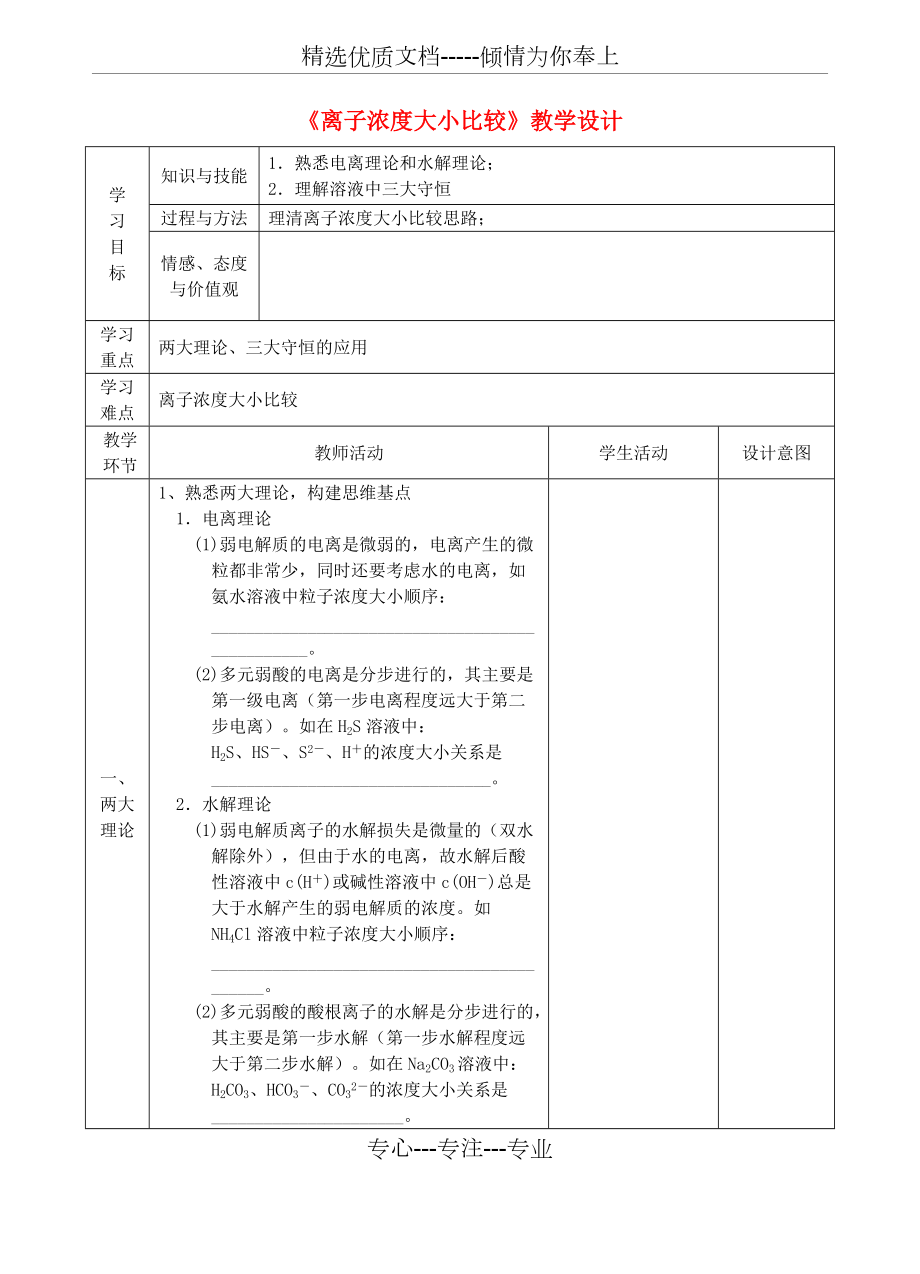
《離子濃度大小比較》教學(xué)設(shè)計
學(xué)
習(xí)
目
標(biāo)
知識與技能
1.熟悉電離理論和水解理論�;
2.理解溶液中三大守恒
過程與方法
理清離子濃度大小比較思路;
情感���、態(tài)度
與價值觀
學(xué)習(xí)
重點
兩大理論�����、三大守恒的應(yīng)用
學(xué)習(xí)
難點
離子濃度大小比較
教學(xué)
環(huán)節(jié)
教師活動
學(xué)生活動
設(shè)計意圖
一�、兩大理論
1�����、 熟悉兩大理論�����,構(gòu)建思維基點
1.電離理論
(1)弱電解質(zhì)的電離是微弱的,電離產(chǎn)生的微粒都非常少�����,同時還要考慮水的電離����,如氨水溶液中粒子濃度大小順序:___________________________
2、_____________________�。
(2)多元弱酸的電離是分步進行的,其主要是第一級電離(第一步電離程度遠(yuǎn)大于第二步電離)�����。如在H2S溶液中:H2S�����、HS-�、S2-、H+的濃度大小關(guān)系是________________________________�。
2.水解理論
(1)弱電解質(zhì)離子的水解損失是微量的(雙水解除外),但由于水的電離�,故水解后酸性溶液中c(H+)或堿性溶液中c(OH-)總是大于水解產(chǎn)生的弱電解質(zhì)的濃度。如NH4Cl溶液中粒子濃度大小順序:___________________________________________。
(2)多元弱酸的酸根離子的水解是分
3�����、步進行的��,其主要是第一步水解(第一步水解程度遠(yuǎn)大于第二步水解)�。如在Na2CO3溶液中:H2CO3、HCO3-���、CO32-的濃度大小關(guān)系是______________________�。
環(huán)節(jié)二����、三種守恒
二�����、把握三種守恒����,明確等量關(guān)系
電荷守恒
物料守恒
質(zhì)子守恒
NH4Cl
CH3COONa
Na2CO3
NaHCO3
等濃度的Na2CO3與NaHCO3的混合溶液中:
電荷守恒:______________________________________;物料守恒:_____________________
4���、_________�。
環(huán)節(jié)三、分析方法
三��、理清一條思路����,掌握分析方法
環(huán)節(jié)四、典例導(dǎo)悟
4���、 典例導(dǎo)悟����,分類突破
(一)單一溶液中離子濃度大小的比較:
1.多元弱酸溶液��,根據(jù)多步電離分析����,如0.1mol/L的H3PO4的溶液中:
2.一元弱酸的正鹽溶液,如0.1mol/L的CH3COONa溶液中:
3.多元弱酸正鹽根據(jù)多元弱酸根的分步水解分析:如0.1mol/L的Na2CO3溶液中:
4. 二元弱酸的酸式鹽溶液�,如0.1mol/L的NaHCO3溶液:
5.不同溶液中同一離子濃度的比較,要看溶液中其它離子對其影響的因素:
(
5��、1)在相同物質(zhì)的量的濃度的下列溶液:①NH4Cl ②CH3COONH4 ③NH4HSO4 ④(NH4)2SO4⑤(NH4)2CO3⑥(NH4)2Fe(SO4)2⑦氨水中c(NH4+)濃度由大到小的順序:___________________���。
(2)濃度均為0.1 mol·L-1的①H2S�、②NaHS、③Na2S���、④H2S和NaHS混合液�,溶液pH從大到小的順序是______________________��。
(3)c(NH4+)相等的①(NH4)2SO4溶液��、②NH4HSO4溶液��、③(NH4)2CO3溶液�����、④NH4Cl溶液��,其物質(zhì)的量濃度由大到小的順序為_______________
6�、________�����。
(二)混合溶液中離子濃度大小的比較:
1.兩種物質(zhì)混合不反應(yīng):
①等物質(zhì)的量的CH3COOH和CH3COONa混合:
②等物質(zhì)的量的NH4Cl和NH3·H2O混合:
2.兩種物質(zhì)其恰好完全反應(yīng):
①10ml 0.1 mol/L NaOH溶液中加入同體積���、同濃度CH3COOH溶液混合:
②100 mL 0.1 mol/L 醋酸與50 mL 0.2mol/L NaOH溶液混合:
3.兩種物質(zhì)反應(yīng)�����,其中一種有剩余
(1)酸與堿反應(yīng)型:
①pH=7型:
常溫下�,將甲酸和氫氧化鈉溶液混合,所得溶液pH=7��,則此溶液中微粒的濃度關(guān)系:___________
7����、__________________________。
②未指明酸堿的強弱:
0.2 mol/L HCN溶液和0.1 mol/L NaOH溶液等體積混合:
③pH之和等于14的酸和堿溶液的混合(判斷過量)
pH=3的CH3COOH與pH=11的NaOH溶液等體積混合:
pH=2的鹽酸與pH=12的氨水等體積混合:
(2)鹽與酸(堿)反應(yīng)型
①弱酸強堿鹽與強酸反應(yīng)后溶液中離子濃度大小的比較
例:將0.1mol/L的醋酸鈉溶液20mL與0.1mol/L鹽酸10mL混合后���,溶液顯酸性����,則溶液中有關(guān)微粒的濃度關(guān)系:______________________________
8����、____________。
②強酸弱堿鹽與強堿反應(yīng)后溶液中離子濃度大小的比較
例:0.2mol/L NH4Cl溶液與0.1mol/L NaOH溶液等體積混合后�,溶液中下列微粒的物質(zhì)的量濃度關(guān)系:__________________________________________。
本堂小結(jié):
當(dāng)堂檢測�、
布置作業(yè)
板
書
設(shè)
計
予少家漢東�,漢東僻陋無學(xué)者�����,吾家又貧無藏書����。州南有大姓李氏者,其于堯輔頗好學(xué)�。予為兒童時,多游其家��,見有弊筐貯故書在壁間���,發(fā)而視之����,得唐《昌黎先生文集》六卷���,脫落顛倒無次序��,因乞李氏以歸。讀之�����,見其言深厚而雄博,然予猶少�����,未能悉究其義.徒見其浩然無涯���,若可愛���。
是時天下學(xué)者楊、劉之作���,號為時文�,能者取科第���,擅名聲���,以夸榮當(dāng)世,未嘗有道韓文者����。予亦方舉進士�,以禮部詩賦為事����。年十有七試于州,為有司所黜�����。因取所藏韓氏之文復(fù)閱之����,則喟然嘆曰:學(xué)者當(dāng)至于是而止?fàn)枺∫蚬謺r人之不道�����,而顧己亦未暇學(xué)���,徒時時獨念于予心�,以謂方從進士干祿以養(yǎng)親�����,茍得祿矣,當(dāng)盡力于斯文����,以償其素志��。
專心---專注---專業(yè)
 2018-2019年高中化學(xué)上學(xué)期《離子濃度大小比較》教學(xué)設(shè)計(共4頁)
2018-2019年高中化學(xué)上學(xué)期《離子濃度大小比較》教學(xué)設(shè)計(共4頁)